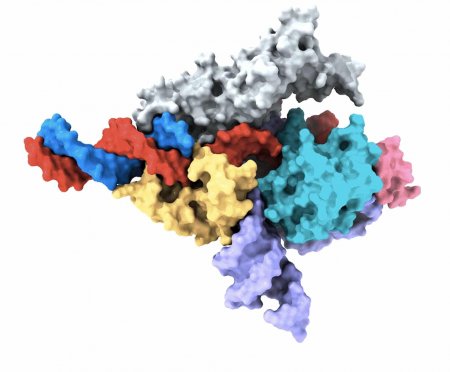
 Изображение белка Fanzor с направляющей РНК, полученное с помощью криоэлектронного микроскопа. Различные части белка окрашены в серый, желтый, голубой и розовый цвета, РНК окрашена в фиолетовый, ДНК-мишень — в красный, а нецелевая цепь ДНК показана синим / © MIT
Изображение белка Fanzor с направляющей РНК, полученное с помощью криоэлектронного микроскопа. Различные части белка окрашены в серый, желтый, голубой и розовый цвета, РНК окрашена в фиолетовый, ДНК-мишень — в красный, а нецелевая цепь ДНК показана синим / © MIT
Группа американских исследователей из Массачусетского технологического института сообщила об открытии первой программируемой РНК-управляемой системы редактирования генома у эукариотов — организмов, включающих царства грибов, растений и животных. Это позволит по-новому взглянуть на проблему редактирования геномов животных и человека, а возможно, и приблизиться к ее решению.
Системы редактирования генома CRISPR/Cas впервые обнаружили в ДНК бактерий еще в конце прошлого века, и с тех пор их активно изучали по всему миру. Впоследствии похожие системы нашли у археев (второго базового домена всего живого), а их применение широко распространилось от генной инженерии тех же бактерий до возможного применения в медицине для лечения наследственных заболеваний человека.
CRISPR — это особые участки ДНК, состоящие из специальных повторяющихся и уникальных последовательностей. Суть уникальных участков — в сохранении частей ДНК чужеродных генов, например вирусов бактерий. Это необходимо, чтобы в случае повторного заражения вирусом бактерия опознала чужеродную ДНК и, при помощи белков Cas и направляющих РНК, разрезала ее на безвредные фрагменты. Тем самым принцип работы систем CRISPR/Cas в чем-то схож с работой иммунной системы человека.
Основная проблема в использовании систем CRISPR/Cas при лечении заболеваний состоит в высокой вероятности их нецелевого срабатывания и разрезания генома в том месте, где это не предполагалось. Одно из возможных решений — поиск похожей системы редактирования ДНК у более близких родственников — эукариотов: к примеру, грибов, растений или животных. Ранние исследования установили, что у бактериальных систем CRISPR/Cas и неких эукариотических белков Fanzor, видимо, был общий предок — прокариотические РНК-управляемые системы геномного редактирования OMEGA.
В новом исследовании ученые из Массачусетского технологического института (США) показали, что белки Fanzor действительно используют специальные короткие фрагменты РНК в качестве ориентира для точного разрезания ДНК-мишени, подобно белкам Cas у бактерий. Тем не менее, в отличие от Cas, белки Fanzor закодированы в эукариотическом геноме в мобильных элементах. На основе этого авторы исследования предположили, что эти гены мигрировали от бактерий к эукариотам посредством так называемого горизонтального переноса генов.
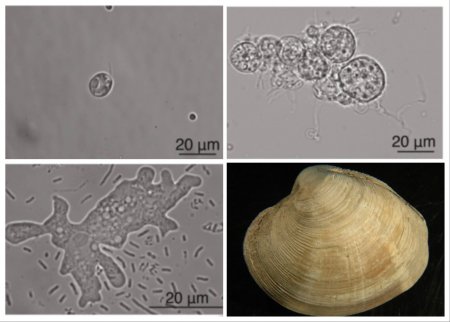
Исследованные организмы: водоросль Guillardia theta, гриб Spizellomyces punctatus, амеба Naegleria lovaniensis и моллюск Mercenaria mercenaria / © Saito M., et al., Nature, 2023
Свои выводы ученые сделали на основе анализа белков Fanzor грибов, водорослей, амеб и двустворчатых моллюсков. Также, чтобы изучить потенциал Fanzor как инструмента редактирования генома, исследователи продемонстрировали возможность генерации вставок и делеций в целевых участках генома в эмбриональных клетках почек человека. Хотя изначальная версия системы Fanzor оказалась менее эффективной, чем стандартные системы CRISPR/Cas, определенная комбинация направленных мутаций позволила на порядок повысить ее эффективность.
Кроме того, коллектив авторов не обнаружил у белка Fanzor, полученного из грибов Spizellomyces punctatus, побочной или нецелевой активности — основной проблемы, затрудняющей использование систем CRISPR/Cas в медицине. Методы криогенной электронной микроскопии показали, что, несмотря на общее структурное сходство со своим бактериальным аналогом, эти белки Fanzor лучше взаимодействуют с направляющей РНК, повышая эффективность и точность редактирования генома.
Ученые уверены, что систему Fanzor, как и системы на основе CRISPR, можно легко перепрограммировать для работы с конкретными участками генома и однажды ее можно будет превратить в мощную новую технологию редактирования для исследовательских и терапевтических применений.
Неотредактированная версия статьи, в которой изложены подробности исследования, опубликована в журнале Nature. Однако отмечается, что в дальнейшем текст могут изменить, поэтому финальная версия может отличаться от нынешней.
Источник: Naked science